1. 원자가 결합이론(valence bond theory)
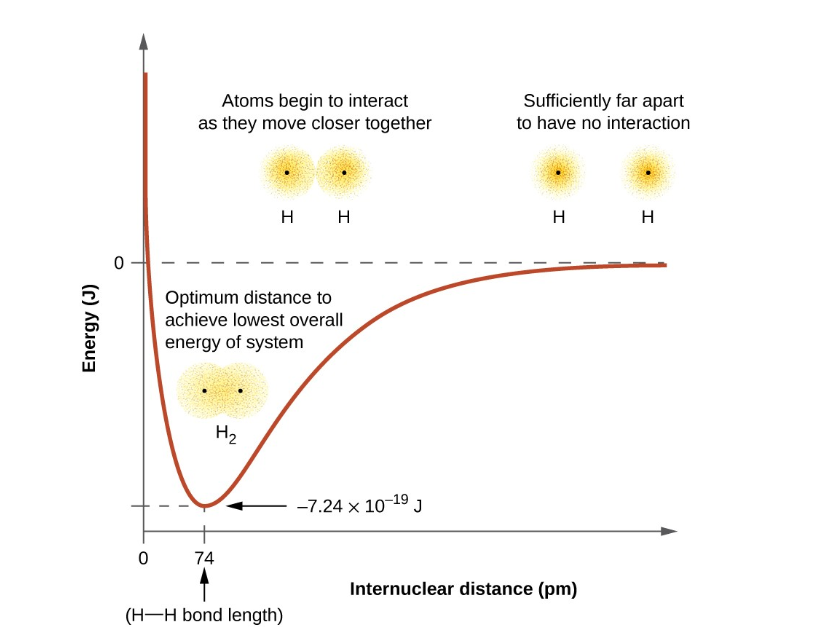
두원자가 가까워지게 되면 특정 거리에서 공유결합을 형성한다.가장 최소화된 에너지 즉, 가장 안정적인 형태를 유지하게 되는 것이다.
공유결합은 오비탈의 중첩에 의해 원자가 전자가 공유되어 형성된다.
이때 전자밀도가 두 원자 핵 사이에 집중되고 에너지가 낮아지고 안정성이 커진다. 공유결합은 두 원자 핵간 거리가 어느정도 유지될 때 일어난다. 이 거리는 공유결합의 bond length 라고 한다.
공유결합을 깨트리려면? 이 에너지(bond strength) 만큼의 에너지를 가해주어야 분리가 가능!
따라서 bond strength는 bond dissociation energy 와 같다.
2. 단일결합에서의 혼성화(Hybridization)
sp3
ex) 메테인 (CH4) 의 경우
다음과 같은 형태로 결합한다.

CH4의 결합각은 4개의 결합 모두 109.5도이다.
여기서 발생하는 의문,
C의 전자배치를 살펴보면 최외각 전자는 다음과 같다.

2개의 unpaired valence electron가 존재하지만 결합은 총 4개를 할 수 있다. 옥텟규칙을 만족시키기 위해서이다. 이를 위해 2s에 있는 전자가 분리되어 Pz로 들어가 총 4개의 unpaired electron이 형성된다.
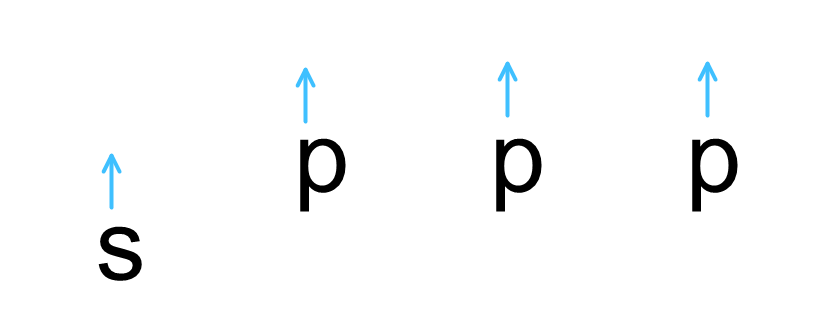
하지만 이 4개의 전자가 각각 결합을 형성하면 s에 존재하는 전자의 결합과 p오비탈에 존재하는 전자의 결합의 에너지는 다를 수밖에 없다. 그러나 CH4는 identical한 결합으로 모든 결합각이 109.5도이다 어떻게 이것이 가능한가?
바로 혼성화 때문이다.
만약 1개의 s 오비탈과 3개의 p오비탈에서 혼성화가 이루어지면 4개의 오비탈의 에너지가 균일해진다.
이것이 sp3혼성이다.


따라서 sp3 오비탈은 위와 같은 형태를 띠게 된다.
1개의 s오비탈과 3개의 p오비탈이 혼성화되어 sp3는 25%의 s, 75%의 p의 특성을 갖는다.
4개의 sp3 오비탈은 서로 가장 안정적으로 존재할 수 있는 형태로 존재하여 반발을 최소화한다
이렇게 형성된 sp3오비탈에 수소의 1s오비탈이 overlap되고 공유결합이 일어난다.
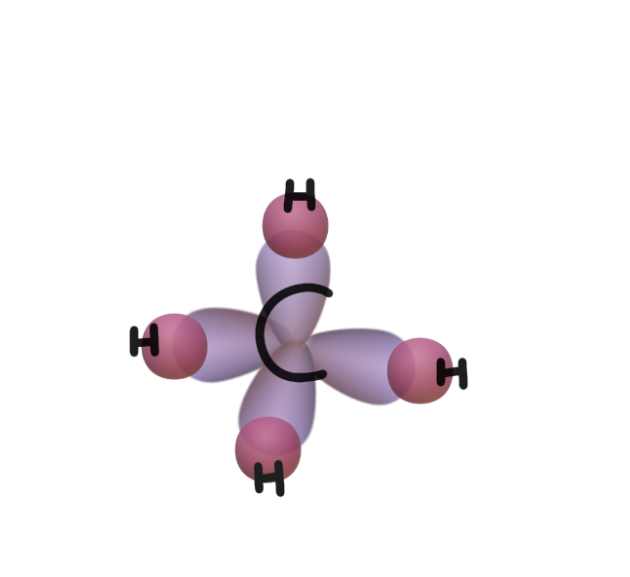
결론 : 메테인은 탄소의 오비탈 혼성화로 sp3가 형성되고 이 때문에 균일한 각의 사면체 구조로 결합한다.
'공부와 대학생활 > 유기화학' 카테고리의 다른 글
| 산과 염기 산 해리 상수 Ka와 pH (0) | 2024.10.30 |
|---|---|
| 혼성화 오비탈과 공유결합 이중결합의 혼성화 -sp2 (0) | 2024.10.06 |
| [유기화학] 원자 오비탈과 전자 배치 (0) | 2024.06.17 |
| [유기화학] 오비탈과 전자 배치이론. 화학 결합. 극성 비극성 공유결합. 쌍극자 모멘트 (0) | 2024.06.14 |
| [유기화학] Alkyl Halides의 반응 Sn1, Sn2, E1,E2 reaction (0) | 2021.04.24 |



