산과 염기
proton : 전자를 잃은 수소이온
산 acid : proton을 주는 species
염기 base : proton을 받는 species
짝산 conjugated acid : 염기가 양성자를 받고 나서의 형태
짝염기 conjugated base: 산이 양성자를 주고 나서의 형태

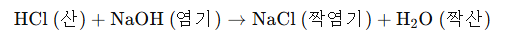
Acidity : 얼마나 proton을 잘 잃는지
Basicity :얼마나 proton을 잘 받는지
강산이다 = proton을 잘 잃는다. 이것의 짝염기는 약염기.
강염기다 = proton을 잘 받는다. 이것의 짝산은 약산
pKa 와 pH
산성물질들의 산성도는 다르다.
예를 들어, 강산은 물 녹였을 때, H+를 더 잘 내주기 때문에 정반응에 의한 생성물이 선호되는 상태로 평형에 도달한다.
상대적으로 약한 산의 경우에는 물에 녹였을 때 양성자를 덜 내놓기 때문에 오히려 역반응이 우세하여 반응물이 선호되는 평형에 도달할 수 있다. 이 경향성을 나타내는 지표가 Ka 산해리상수이다.
Ka ( 산 해리 상수, acid dissociation constant)
물질이 양성자를 잃는 경향성을 나타냄


- [H+]: 해리된 수소 이온의 농도
- [A−]: 짝염기의 농도
- [HA]: 해리되지 않은 산의 농도
Ka가 클수록 강산이다. = 양성자를 잘 잃는다.
pKa를 통해서 acid가 강산인지 약산인지를 비교할 수 있다
pKa = -logKa
pKa < 1 매우 강산
1~3 강산
3~5약산
5~15 매우 약산
pKa > 15 매우매우 약산
pH란?
용액 내의 양성자의 농도에 로그와 음수를 취한 값.
pH = -log[H+]
pH가 낮을수록 용액이 산성이다. 일반적으로 pH 7 보다 작으면 산성 크면 염기성으로 본다. 7이면 중성이다.
pH와 pKa의 차이
pH는 용액의 산성도
pKa는 물질이 양성자를 잃는 경향성을 나타냄. 따라서 pKa는 물질의 고유 특성이다. pH는 상황에 따라 달라진다.
'공부와 대학생활 > 유기화학' 카테고리의 다른 글
| [유기화학] 이성질체의 정의와 분류 (0) | 2025.02.25 |
|---|---|
| [유기화학]산성도(Acidity)에 영향을 주는 요인 산성도 비교 방법 (0) | 2024.11.11 |
| 혼성화 오비탈과 공유결합 이중결합의 혼성화 -sp2 (0) | 2024.10.06 |
| 원자가 결합 이론과 공유결합 / 단일결합의 혼성화 - sp3 (0) | 2024.07.14 |
| [유기화학] 원자 오비탈과 전자 배치 (0) | 2024.06.17 |


