[원자 오비탈]
전자는 오비탈 내에 존재한다. 전자가 존재할 확률이 있는 부분을 3차원으로 나타낸 것을 원자오비탈 혹은 전자구름이라고 한다.
s orbital
⇒ s 오비탈의 경우, 구의 형태를 갖는다. 즉 전자의 90%이상이 이 오비탈 내에 존재한다는 것을 의미한다.
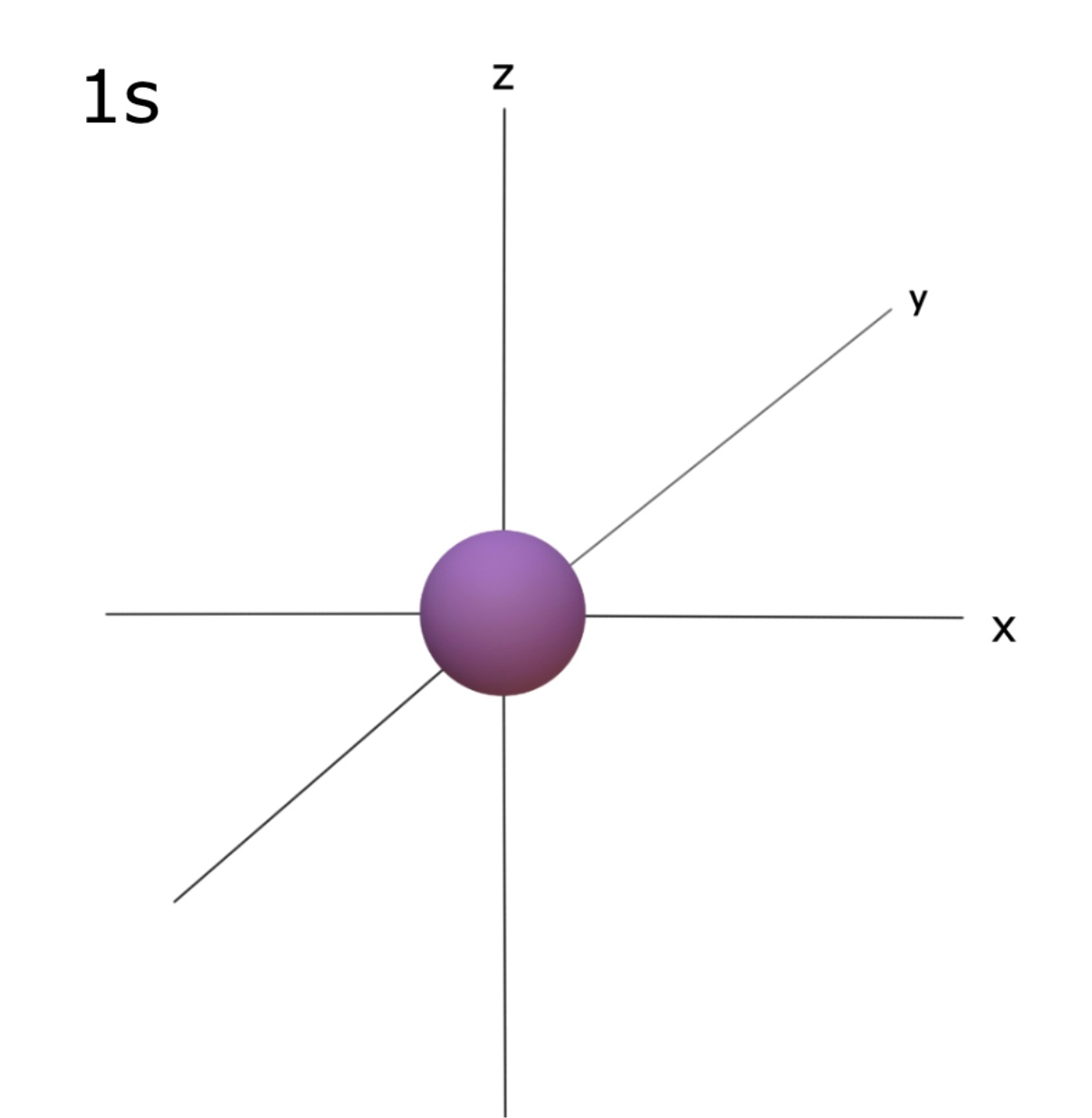
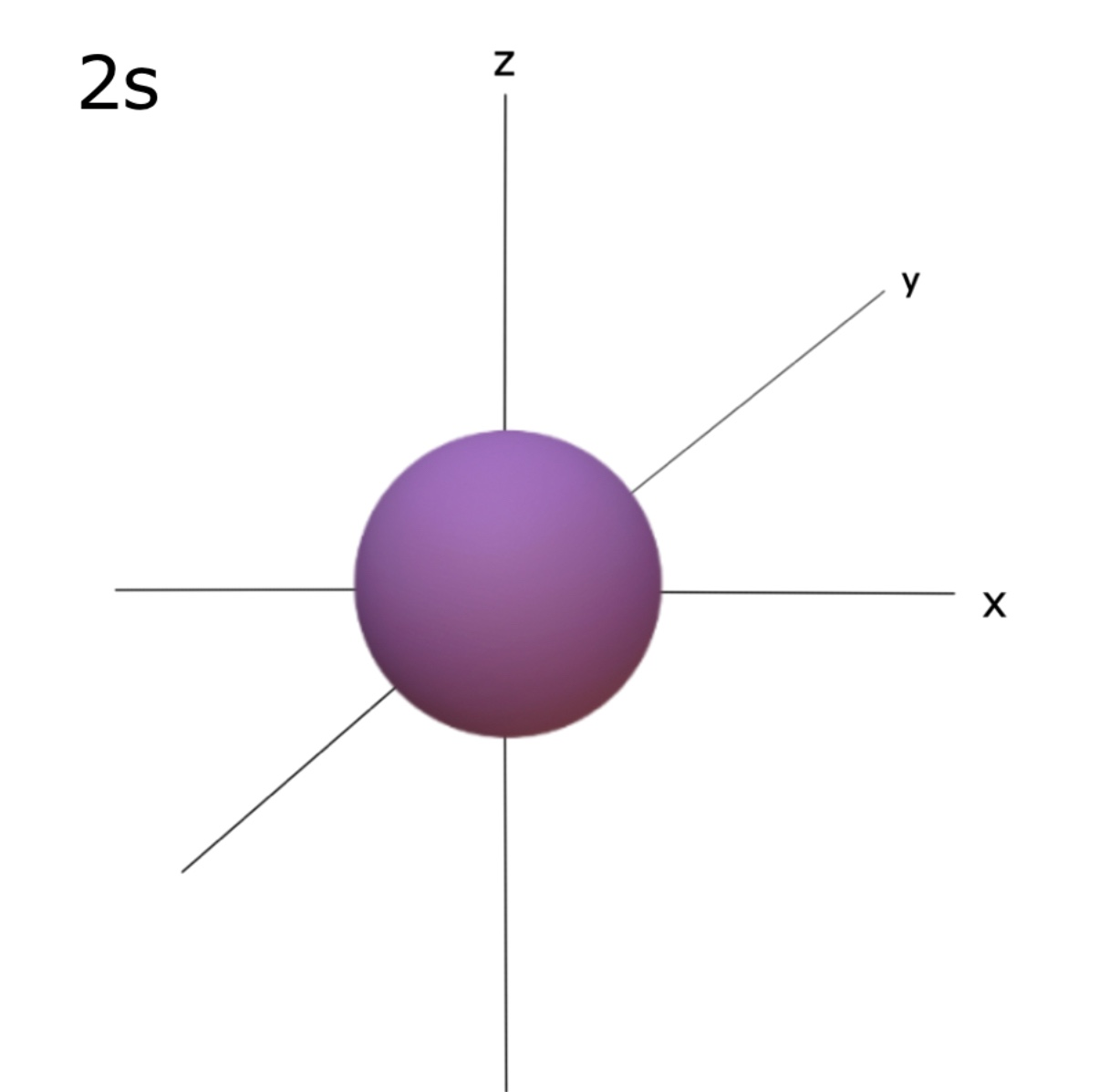
⇒ 1s는 원자핵에 가장 가까우며 오비탈 주양자수가 커질수록(2s, 3s…) 오비탈 크기도 커진다. 1s 와 2s 오비탈을 비교했을 때, 두 번째 shell은 첫 번째 shell보다 핵으로부터 멀리 존재하고 이로 인해 2s의 구의 크기가 1s 보다 큰 것이다.
⇒ 오비탈 크기가 커진다는 것은 더 넓은 범위에 전자 존재 확률이 있는 것으로 전자 밀도는 더 낮아진다.
⇒ S 오비탈 사이에는 전자 존재 확률이 0인 node가 존재한다.
p orbital
⇒ p 오비탈은 아령모양의 형태를 갖는다.
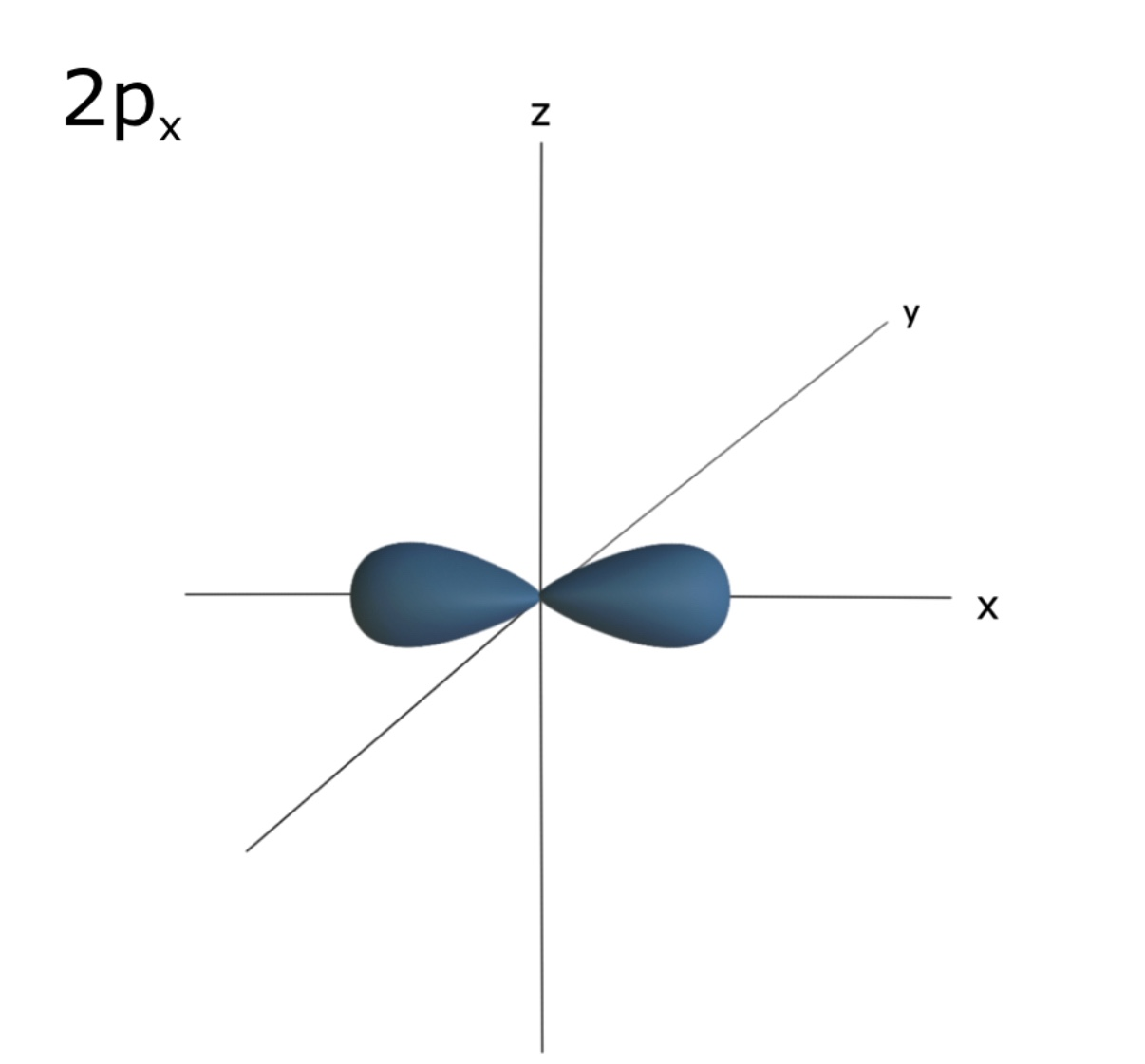
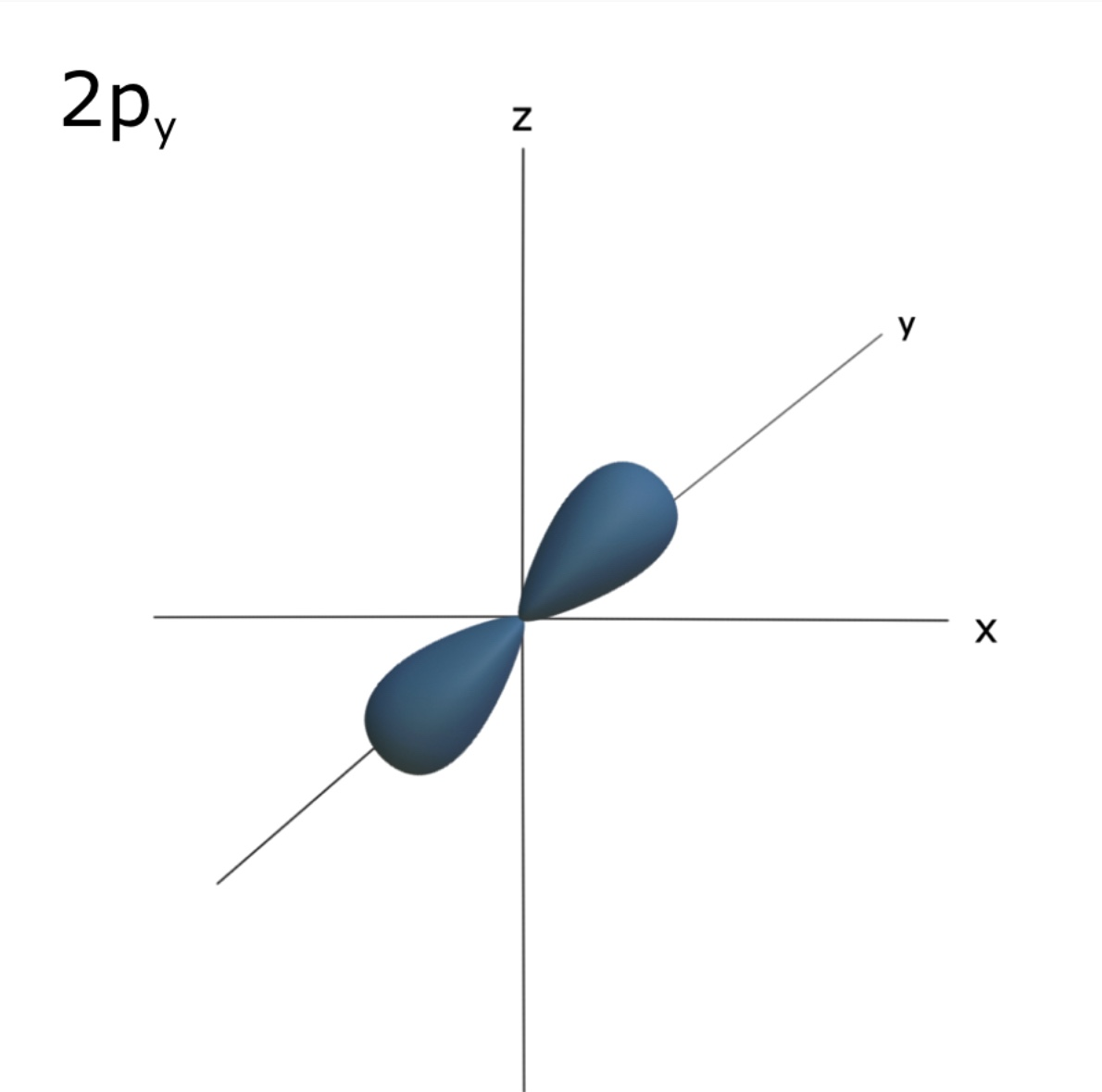
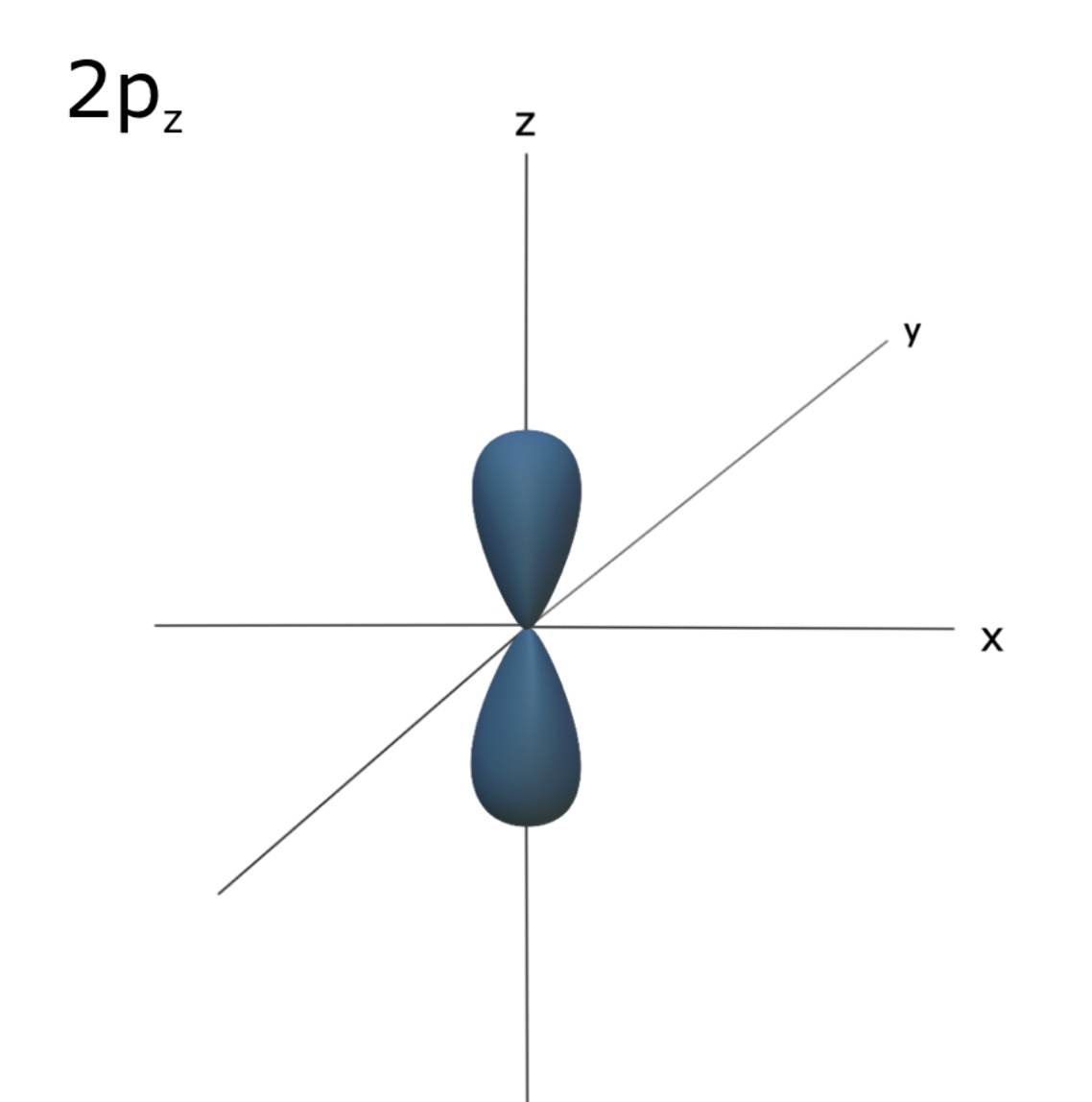
⇒2 이상의 shell에서 존재하고, 3개의 p 오비탈을 갖는다. 각각의 p 오비탈은 같은 에너지를 가지며 x,y,z 축 방향으로 각각 존재한다. 하나의 p오비탈에 전자 2개 들어가고 총 6개 들어간다.
⇒ 2p 오비탈은 2s 오비탈보다 약간 더 높은 에너지 값을 갖는다. 그 이유는? 2p 오비탈 내의 전자가 2s보다 핵으로부터 조금 더 멀리 존재하기 때문이다. (핵으로부터 멀어질 수록 에너지는 증가!)
전자배치
이전 글 참조.https://drawnunu.tistory.com/89
[유기화학] 오비탈과 전자 배치이론. 화학 결합. 극성 비극성 공유결합. 쌍극자 모멘트
Ⅰ 원자 내의 전자 배치[Atomic Orbitals(원자 오비탈)]원자 내에 전자가 존재할 확률이 있는 공간. 특정한 에너지를 갖는 전자가 존재할 수 있는 위치를 나타낸다.전자구름이라고도 한다. [일반화학
drawnunu.tistory.com
[n+l 규칙]
각 오비탈의 상대적인 에너지를 비교할 수 있는 공식.
주양자수(n)과 부양자수(l)의 합이 클수록 큰 에너지를 갖는다. (불안정하다)
두 값의 합이 같은 경우, 주양자수가 작은 오비탈이 더 작은 에너지를 갖는다.(더 안정하다)
⇒ n+l 값이 작은 오비탈부터 전자가 채워진다.
⇒ n+l값이 같으면 n값이 작은 오비탈부터 전자가 채워진다.
다음 부등식은 오비탈의 상대적인 에너지이자, 전자가 채워지는 순서를 나타낸 것이다.
1s<2s<2p<3s<3p<4s<3d<4p
3p와 4s 비교
3p 오비탈은 주양자수(n)=3. 부양자수(l)=1, 즉 n+l= 4
4s 오비탈은 주양자수(n)=4, 부양자수(l)=0 즉 n+l= 4
즉, n값이 더 작은 3p 오비탈부터 전자가 채워진다.
4s와 3d 비교
4s 오비탈은 주양자수(n)=4, 부양자수(l)=0 즉 n+l= 4
3d 오비탈은 주양자수(n)=3, 부양자수(l)=2 즉 n+l=5
즉, n+l값이 더 작은 4s 오비탈부터 전자가 채워진다.
'공부와 대학생활 > 유기화학' 카테고리의 다른 글
| 산과 염기 산 해리 상수 Ka와 pH (0) | 2024.10.30 |
|---|---|
| 혼성화 오비탈과 공유결합 이중결합의 혼성화 -sp2 (0) | 2024.10.06 |
| 원자가 결합 이론과 공유결합 / 단일결합의 혼성화 - sp3 (0) | 2024.07.14 |
| [유기화학] 오비탈과 전자 배치이론. 화학 결합. 극성 비극성 공유결합. 쌍극자 모멘트 (0) | 2024.06.14 |
| [유기화학] Alkyl Halides의 반응 Sn1, Sn2, E1,E2 reaction (0) | 2021.04.24 |



